实现多色流式完备方案的七大技巧
1. 荧光染料选择
并非所有染料都是一样的! 有些染料非常明亮,而其他染料则显得黯淡。 然而,选择最亮的染料并不总是最聪明的决定,避免弱光染料并不总是谨慎的。 通常,建议使用足够亮的染料来检测感兴趣的抗原,同时使溢漏量最小或避免渗入其他探测器。当一个荧光染料的发射光谱被为测量其它荧光染料发射的探测器检测到时,就会发生溢漏,从而在第二个荧光染料通道中产生不需要的信号。更明亮的发射意味着更多的溢漏和更多的数据弥散,这可能导致分辨率受损。为了避免这种情况,在弱表达的抗原上使用较亮的染料,相反,在强表达抗原上使用稍暗淡的染料。遵循这个规则将帮助您更加自由的使用染料!
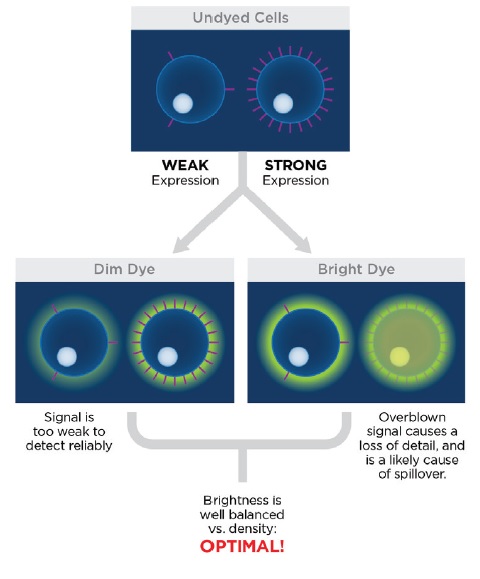
2. 通道选择
直面事实,溢漏常有发生,但你仍然可以为你的组合优化染料的选择 – 为强表达抗原(绿色列)选择可以减少影响其他通道的荧光染料,同时分配弱表达抗原其检测通道仅受其他荧光染料溢漏(黄色行)轻微影响的荧光染料。荧光染料是否属于上述类别之一将取决于仪器配置和荧光染料的选择。请务必测试荧光染料和通道组合,为您的搭配找到最佳阵容。
在设计利用所有可用通道的实验时,避免溢漏可能具有挑战性,但这些提示可以帮助您减少溢漏效应对组合和结果数据的影响。

3. 抗原排斥
什么是相互排斥的抗原之间产生的少量溢漏? 如果两个抗原不同时表达在你感兴趣的同一群细胞上,则这两个抗原的发射光谱之间的溢漏不会干扰您的组合 。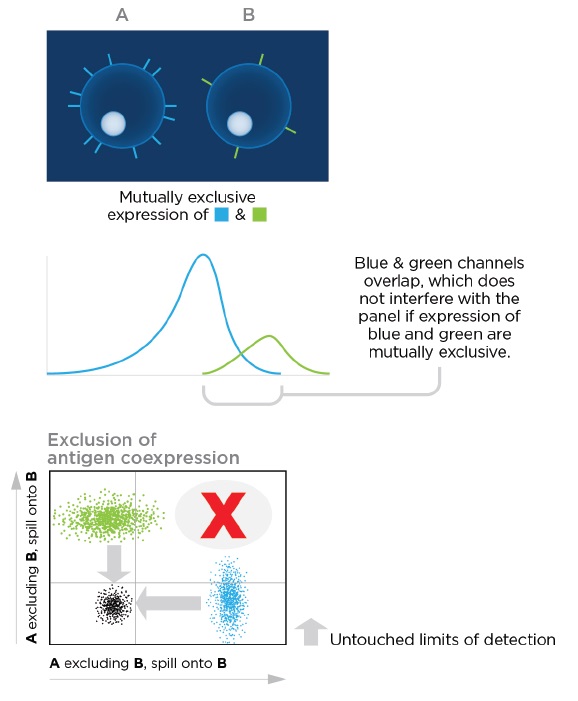
4. 抗原共同表达
如果一个标记典型地或潜在地具有改变的或弱表达的密度,则应尽量减少共表达抗原的荧光染料标签溢漏到该标记的通道,因为溢漏可能会遮挡您的数据及造成假性结果。只有非共表达抗原荧光染料标签的溢漏才是安全的,并且不会影响可变或弱表达抗原的灵敏度和分辨率。
5. 父代-子代
涉及到父代并不总是一件不好的事? 对于多色流式细胞试剂方案,子代影响到父代可以保持标记之间的灵敏度。 解释:您可以允许子集或子群(后代)标记溢漏到或串扰到门控标记(父代)。 父代标记将允许此溢漏,因为子代对于父代的标记始终为阳性。 例如,如果 CD4 在淋巴细胞门内的 CD3 通道中显示强烈的溢出效应,则背景扩散不会导致 CD3 通道中的背景扩散,因为 CD4+ T 细胞也是 CD3+。 注意相反的情况,即父代标记对子代标记有串扰,因为父代信号的溢漏将污染子代信号的背景。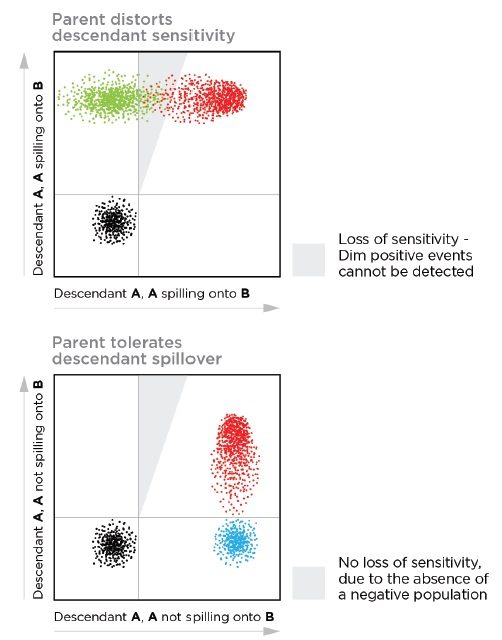
6.正阈值
如果目标是识别明亮的阳性细胞群,或区分明亮与中等强度/弱表达强度的细胞群,则溢漏到共表达抗原是被允许的。但是,当目标仅为区分弱表达和阴性表达细胞群时,溢漏不被允许,因为这将使您的数据和结论混乱,导致假阳性。
7. 溢漏复杂性
告别复杂性,并尝试保持溢漏模式尽可能简单和直接,以避免表型相关的检测限制。 但是请记住,没显示在你的点图中的荧光染料也会溢漏和扩散,因此 “保持简单” 可能相当复杂!

在规划下一个多色流式细胞测定时,请记住这 7 个提示,您的组合将回报给您尽可能好的信号检测和更高的结果确定性,同时降低复杂度。为了进一步提高使用多色流式细胞术的成功几率,请使用经过监管机构和制造标准的严格审查的高质量和稳健的试剂。
试剂越可靠,数据就越可靠!
*仅供工业和科研使用,不用于临床诊断

