洁净室常规环境监测 —— FDA 关于 21 CFR Part 11 数据完整性要求
摘要
最近的一份报告表明,FDA向生物制药行业发出的483警告信中约有79%数据完整性方面存在缺陷1。尽管获得了FDA的指导,洁净室环境监控仍然是一个高度手动的过程,人为错误有很多机会造成数据中的空白和错误。在其21 CFR 第11部分指南中,FDA提出了关于良好数据完整性的建议,说明了他们在当前洁净室环境实践中的建议,并展示了如何通过FDA指南改善数据完整性。
请滚动至页面底部,点击观看本次主题相关的网络研讨会。

洁净室常规环境监测
当然,FDA规定了洁净室中生物药/化药生产的空气质量条件。实际上真正的危险是人体上的微生物。人类每小时脱落约30,000个皮肤细胞2,所有这些细胞都是潜在的微生物携带者。不幸的是我们目前尚无实时检测空气中微生物的技术。因此空气颗粒计数器被作为替代物使用。
作者与世界各地工厂的环境监测经理之间的讨论表明,一个日益增长的趋势是,进行环境监测的负担正从质控微生物团队转移到生产人员,原因有两个:a)微生物人员相对而言 进行此类日常任务的成本很高; b)减少了洁净室内的人数,从而减少了产品污染的可能性。 但是,生产团队对日常环境监测的了解程度不高,这本身就构成了挑战。
在较大的生物制药工厂中,可能有10名或更多技术人员组成的团队,每个月要收集数千个常规环境监测样本。 在每个位置,他们必须在开始采样之前在计数器中手动输入位置名称。 必须按照书面的SOP手动配置计数器。 每天结束时,必须对每个样品位置的纸张打印输出进行复印,因为颗粒计数器中的打印机是热敏的,打印输出随时间而褪色。 然后,必须手动将每个位置的结果逐一转换为电子格式。
| 接触点 1 | 接触点 2 | 接触点 3 | 接触点 4 | 接触点 5 |
|
• 确保SOP 正确无误 • 阅读并理解SOP
|
手动输入每个采样点的名称 |
手动配置计数器: • 采样时间 • 样本数量 • 结果平均值 • 正确地换算为立方米 |
打印文件并复印 | 手动录入测量结果 |
在出现环境数据错误后,典型的应对方法是要求团队进行重新培训。 但是,该行业和FDA逐渐认识到,再培训治标不治本,无法解决根本问题,不久人为错误会再次蔓延,正确的方法是减少SOP中的手动步骤,以减少人为错误并使整个过程更加稳健
FDA 关于数据完整性的指南
FDA在其21CFR第11部分数据完整性规则3的实施指南中,使用缩写词 ALCOA,在其中定义了良好的数据完整性做法,创建的记录可归属于进行测试的技术人员,而且清晰可辨,同时创建, 原始准确。
可归属,意味着记录应以某种方式可追溯到进行测试的技术人员。 它们还应包括一个标签,说明在何处采集样品以及采集日期和时间。
清晰可辨,意味着手写记录是不可接受的。 FDA继续建议,电子记录应以开放的格式存储,并可以以多种格式读取,以便在以后的几年中可以访问和读取。 FDA建议使用典型格式例如PDF,XML或SGML3
同时创建,表示应在测量样品后立即创建电子记录,这意味着手动抄写纸质记录不是一种好习惯,并且后续整理纸质记录再手动将其转录为电子记录也不是一个好习惯。
原始准确,电子记录自然应该是准确的。 这意味着捕获那些电子记录的过程应该是稳健的,也意味着应该避免人为错误机会的手动计算和手动数据输入
现在我们根据 FDA ALCOA 指南看一下当前的情况。 在典型的过程中,有许多手动步骤,并且纸质记录通常不包含电子签名,因此不能归属于技术人员。 手动为每个位置键入样本位置,这会导致人为错误和错误键入,使样本不能很容易地归属于样本位置。 通常,最终的电子记录清晰可辨,但肯定不是同时创建的,而是由热敏打印机创建的原始纸记录并随着时间的推移而逐渐消失,因此最终的记录不是原始的,而是手动创建的 ,最终记录无法保证准确。
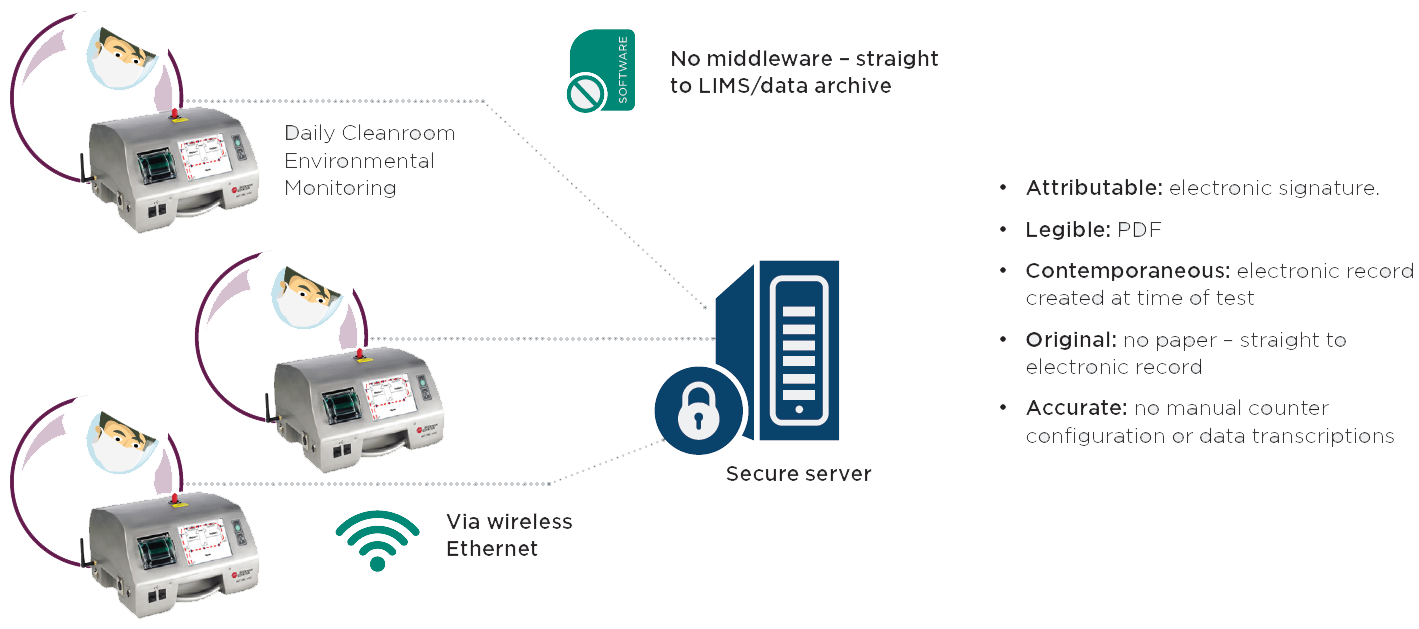
图 4. MET ONE 3400 空气颗粒计数仪自动化的常规环境监测SOP有助于数据的完整性
幸运的是,现在存在更合规的解决方案。贝克曼库尔特MET ONE空气颗粒计数器可以对采样SOP和位置进行预编程和自动设置,以消除手动输入样品位置和计数器配置步骤。 计数器可以立即生成包含用户电子签名和样本位置名称的电子记录,而不必产生后续手动转录的纸质记录。该电子记录采用FDA推荐的格式之一PDF,并且可以通过网络传输到安全的服务器,用户可以在其中保存最终记录。 这消除了所有手动配置步骤,手动位置键入和手动数据转录,从而减少了人为错误的机会并提高了数据完整性。
总结
在许多情况下,洁净室的常规环境监测流程因为手动操作SOP,并需要将成千上万的数据记录手动转录为电子格式,仍然存在很高的人为错误风险。无论对员工进行多长时间的培训,此类流程都很容易出错,并对数据完整性带来影响。MET ONE颗粒计数器的自动化技术可以帮助缓解这一问题,并使这些测量过程更加稳健,减少对数据完整性的影响,同时也有助于企业将常规环境监测任务从专业的微生物专家转移至洁净室生产人员手中,从而帮助企业进一步降低成本。
参考资料
- Pharmaceutical Online, An Analysis Of FDA FY2016 Drug GMP Warning Letters By Barbara Unger, Unger Consulting Inc. https://www.pharmaceuticalonline.com/doc/an-analysis-of-fda-fy-drug-gmp-warning-letters-0001, published January 16, 2017.
- Health How Stuff Works, How many skin cells do you shed every day? by Ed Grabianowski. http://health.howstuffworks.com/skin-care/information/anatomy/shed-skin-cells.htm, published July 6, 2010
- U.S. Department of Health and Human Services Food and Drug Administration Guidance for Industry, Part 11, Electronic Records; Electronic Signatures — Scope and Application, August 2003 U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER) Office of Regulatory affairs (ORA) Division of Drug Information, HFD-240 Center for Drug Evaluation and Research Food and Drug Administration 5600 Fishers Lane Rockville, MD 20857 USA

