21 CFR 第 11 部分关于在线 WFI 仪器的数据完整性要求
摘要
背景介绍
TOC 和电导率是美国药典 3 中为 WFI 和 PW(纯净水)定义的四项关键质量属性中的其中两项。贝克曼库尔特公司的 ANATEL PAT700 在线分析仪经过验证,完全符合药典对这两项关键质量属性的要求。
FDA 过程分析技术(PAT)倡议书4鼓励制药行业通过部署过程控制仪器来确保工艺过程中的质量控制,摆脱过度依赖最终产品质量检测的局面。此外还鼓励企业在批量生产前的质量检测一次过关,因为药品的最终产品检测具有破坏性,并非 100% 适用。为此,许多制药企业将其在线 TOC 分析仪接入工厂控制系统,以便在检测到任何潜在 TOC 和电导率偏移时停止生产,防止可能受到污染的水混入宝贵的活性药物成分中。随着《欧洲药典》(EP)中关于 WFI 章节的修订,现已允许使用二级反渗透系统(RO)和超滤5生产WFI,与水蒸馏器提供的安全屏障相比,制药用水系统的TOC 和电导率监测因可感知 RO 系统中潜在的破坏性污染风险而愈发重要。
FDA ALCOA原则
在 2003 年关于执行21 CFR 第11部分数据完整性规则的指南中,FDA 采用了首字母缩略词“ALCOA”,简而言之,FDA 期望数据与其来源相关联。创建的记录可归属于进行测试的技术人员,而且清晰可辨,同时创建, 原始准确。参见产品支持 ALCOA 指南。

可归属性(A)
“可归属性”是指数据记录中应包含一个电子“签名”,可将其与执行测量的仪器/用户相关联,并可追溯至数据本身的来源(包括受测水系统的参考信息以及测量日期和时间等)。这意味着登录系统的用户要有电子签名。电子签名的格式控制可能针对具体地点,通常由 IT 部门使用 Microsoft Active Directory(微软活动目录)来控制。理想情况下,在线仪器应配置为遵循 Active Directory 的控制,以确保电子签名格式正确,符合特定地点的规则。
清晰可辨(L)
记录应清晰可辨,这意味着手写记录将被替代。FDA 还建议电子记录应以开放格式存储,并支持多种计算格式,以便未来几年内的访问和读取。FDA 推荐的常用格式有 PDF、XML 或 SGML。
同时创建(C)
“同时创建”一词意味着电子记录应在样品测量后即时创建。因此不推荐手动转录和整理纸质记录,也不推荐在未来的某个时间点手动将其转录为电子格式。
此外,每次手动将测试结果从一种形式转录为另一种形式都必然存在人为误差。即使将多份纸质记录扫描成电子格式,也存在重复或遗漏扫描的风险。因此 FDA 建议电子记录应为测试完成时即时创建的原始记录。显然,人工转录的记录风险最高,有可能引发最严重的人为错误。
ALCOA 中的最后一个字母 A 代表着“准确性”。这意味着获取这些电子记录的过程应该是健全的,即应该避免可能产生人为错误的手动计算和手动数据输入过程。
可归属记录
ALCOA 中的第一个字母‘A’代表可归属性。在线仪器产生的电子记录应能关联至执行测量的仪器、测量时间和日期等信息。
如同 ANATEL PAT700 能够同步抓样和分析的在线分析仪,应能通过电子签名将抓样分析产生的数据归属于执行测试的用户。
应能够设置多级用户登录权限,日常用户无需登录便可查看当前的在线 TOC 结果,登录用户方可对设置进行修改、实施校准或对系统适用性进行测试。
登录到系统的用户应该在一个可设置的非活动时间段后自动注销。
应具备强制用户定期更新密码的功能,且不允许用户重复使用之前已使用过的密码。
在理想情况下,当地 IT 团队对用户实施并在微软活动目录控制中定义的控制也应在在线 TOC 分析器中实施。
数据储存库
FDA 在其指南中强调 21 CFR 第 11 部分的规定仅适用于保存电子记录的历史数据。内置本地历史数据记录器的在线仪器面临的风险是,它们可能会违反 21 CFR 第 11 部分规定的全部要求。采用 PAT700 等分析仪可通过允许禁用本地数据历史记录来避免这一问题,从而确保作为电子记录数据存档的历史记录不会违反 21 CFR 第 11 部分的要求。
来自在线 TOC 分析仪的数据历来被储存于经验证的数据采集和监视控制系统(SCADA)或分布式控制系统(DCS)中,这为过程控制的改进带来挑战,并增加了大量的变更控制操作。更现代的方法是将质量关键数据记录保存在一个单独的安全数据库中,将 SCADA 和 DCS 系统专门用于过程控制,使操作更为灵活。为此可将 PAT700 配置为通过以太网使用安全的 FTP 自动发送 PDF 电子记录,从而满足 ALCOA 原则对电子记录的清晰可辨,同时创建, 原始准确和可归属性要求。
对报告进行数据归档时,可由安全的 FTP 通过以太网在预定的时间间隔内自动导出为 PDF 文件并自动归档至远程安全数据库中。

贝克曼库尔特 ANATEL PAT700 通过以太网直接以 PDF 文件格式导出数据档案
手动 SOPs vs 电子 SOPs
ANATEL PAT700 满足了 ALCOA 中的“A”所代表的原始准确要求。因为其所有必要的标准操作程序(SOPs)均通过自动化执行,并以电子 SOPs 格式预先编程到分析仪中,无需手动配置。在进行校准或系统适用性测试时,无需进行手动计算,也无需手动输入数据,因为分析仪会自动识别标准样品瓶 RFID 标签上所含的零件号、批次号和有效期等信息。
手动计算
为合格/不合格报告进行手动计算时,如产生人为错误则会影响 ALCOA 中有关原始准确(A)和同时创建(C)要求。理想情况是,合格/不合格的计算标准应内置于分析仪中,以便由分析仪自动进行计算并生成报告。PAT700 内置 FDA 标准,并直接自动生成 PDF 格式的合格/不合格报告,满足 ALCOA 原则对测量记录的原始准确和同时创建的要求。
最终电子记录的安全性备受关注,但在手动数据录入和手动计算等过程中依然存在着许多产生错误记录的风险。
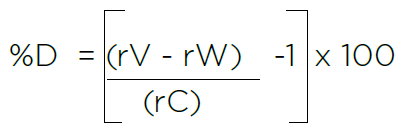
人工计算可能引发人为错误
例如:
rV = 蔗糖验证标准三次测量的平均 TOC 响应
rW = 蔗糖验证标准三次测量的平均 TOC 响应
rC = 验证标准分析证书上经认证的 TOC 值
校准
任何使用手动 SOPs 和手动计算进行的校准,均不可避免产生很高的人为错误风险。贝克曼库尔特 ANATEL PAT700 包含所有必要的电子格式 SOPs,校准标准通过 RFID 技术自动将其零件号、批次号和有效期导入 PAT700,且这些数据将以 pdf 格式呈现在校准报告中。

贝克曼库尔特 ANATEL PAT700 校准标准通过 RFID 射频识别技术自动导出含有认证值、批号和有效期等数据。
再培训 vs. 稳健的电子程序
通常,数据出现错误后的标准响应是要求对团队人员进行再培训。但相关行业和 FDA 逐步认识到,再培训只能短暂的治标而非治本,人为错误还会再次出现。正确的方法是减少 SOP 中的人工步骤以减少人为错误,使整个过程更加稳健。
总结
随着《欧洲药典》对 WFI 生产规则的放宽,关键的在线水质分析仪变得愈发重要。手动计算和有纸化 SOPs 让人为错误悄然而至,而再培训只能短暂治标而非治本。为此,针对药物质量控制优化的仪器(例如贝克曼库尔特的 ANATEL PAT700 TOC 和电导率分析仪)提供了一种创新技术,该技术通过自动化 SOPs 和自动校准从而获得更加稳健的测量结果。随着市场对成本控制和优化的日益关注,用户(特别是生物制药行业)应更多考虑如何增强其在线质量控制仪器的稳健性,以防止宝贵的活性药物成分产品的损失。
参考资料
- Pharmaceutical Online, An Analysis Of FDA FY2016 Drug GMP Warning Letters By Barbara Unger, Unger Consulting Inc. https://www.pharmaceuticalonline.com/doc/an-analysis-of-fda-fy-drug-gmp-warning-letters-0001
- U.S. Department of Health and Human Services Food and Drug Administration Guidance for Industry, Part 11, Electronic Records; Electronic Signatures — Scope and Application August 2003 U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER) Office of Regulatory affairs (ORA) Division of Drug Information, HFD-240 Center for Drug Evaluation and Research Food and Drug Administration 5600 Fishers Lane, Rockville, MD 20857 USA
- U.S. Department of Health and Human Services Food and Drug Administration United States Pharmacopoeia U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER) Office of Regulatory affairs (ORA) Division of Drug Information, HFD-240 Center for Drug Evaluation and Research Food and Drug Administration 5600 Fishers Lane, Rockville, MD 20857 USA
- U.S. Department of Health and Human Services Food and Drug Administration Guidance for Industry PAT — A Framework for Innovative Pharmaceutical Development, Manufacturing, and Quality Assurance September 2004 U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER) Office of Regulatory affairs (ORA) Division of Drug Information, HFD-240 Center for Drug Evaluation and Research Food and Drug Administration 5600 Fishers Lane, Rockville, MD 20857 USA https://www.fda.gov/regulatory-information/search-fda-guidance-documents/pat-framework-innovative-pharmaceutical-development-manufacturing-and-quality-assurance
- Council of Europe European Directorate for the Quality of Medicines & Healthcare European Pharmacopoeia (Ph. Eur) 9th Edition. EDQM Council of Europe, 7 allée Kastner, CS 30026, F-67081 Strasbourg, France https://www.edqm.eu/en/news/european-pharmacopoeia
“Active Directory”是微软公司在美国和/或其他国家的注册商标或商标。

