DxFLEX标准化研究
Vincenzo Di Ruocco, Marta Parra, Annabelle Chauveau, Margot Grandl, Mireia Dalmau, Jose Antonio Delgado |贝克曼库尔特生命科学公司
在此页面您将了解:
-
如何简化不同DxFLEX仪器间标准化设置的工作流。
-
了解DxFLEX如何采用单一标准化设置,降低仪器校准设置的复杂性,简化工作流,从而节省实验室成本及研究人员的宝贵时间。
-
探索DxFLEX如何在标准化设置后支持同一实验室内和不同实验室间的结果一致性,获得可重现且可靠的实验结果。
前言
在流式细胞术免疫表型分析中,不同实验室间的结果可比性至关重要,这是区分生物学变化和技术性伪影的关键基础1, 2.
各类文献对流式细胞术复杂的标准化过程,进行了广泛综述4, 5, 其中包括panel marker设计、样品处理、系统设置和仪器性能监测等多个概念。从使用者的角度而言,控制难度最大的当属::仪器设置、性能监测、补偿矩阵计算及每个荧光检测器的电压/增益设置等几个方面。
仪器性能日常监测可确保分析具有可重现性,同时使不同仪器所生成直方图中的细胞簇位置得以标准化3 。通过设置电压/增益,将对照颗粒置于特定目标通道中,即可获得相对类似的仪器设置4, 5 。 如果一个或多个参数超出目标MFI(平均荧光强度)范围,系统性能或将受到影响。如需重新调整,则电压/增益变动以及将这些变动应用于panel设置时必须人工手动完成。如此一来,不同仪器间的标准化不但难以实施而且耗时耗力。
全新DxFLEX包含一个QC/标准化模块,可自动启动仪器质量控制和标准化程序。质量控制程序用以检查仪器是否具有足够的信号强度及精度。该模块可监测MFI(平均荧光强度),跟踪任何特定检测的增益变化,并将其与panel实验设置直接关联,以便自动进行修改。
在本文中,我们将回顾完整的标准化设置过程,并讨论多实验室间经标准化设置的研究结果。
材料与方法
本次研究将对不同地点的三台DxFLEX进行标准化设置。它们分别位于:
- 德国莱比锡大学
- 西班牙巴伦西亚Hospital Dr Peset医院
- 法国巴黎贝克曼库尔特FR
为了尽量避免因样品和抗体处理而导致的实验结果差异,本次研究还引入了其他贝克曼库尔特解决方案:
- 样品: ClearLLab Control Cells Normal,一款稳定的人红细胞和白细胞液体制剂,用于验证免疫表型分析相关步骤的准确性/可重现性。(贝克曼库尔特产品编号:B90002)
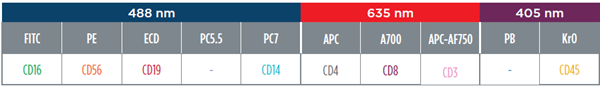
- MoAb Panel组合:DURAClone IM Phenotyping Basic Tube kit*,由专家设计的临床研究用干粉抗体组合,有效避免易出错的抗体移液步骤及繁杂的试剂库存管理。(贝克曼库尔特产品编号:B53309)
图1. DURAClone IM Phenotyping Basic Tube kit仅用于研究,不用于诊断。
其他材料:
- 12 x 75 mm塑料试管
- PBS缓冲液(贝克曼库尔特产品编号:6603369)
- Flow-Set Pro微球(贝克曼库尔特产品编号:A63492*)
- Versalyse裂解液(贝克曼库尔特产品编号:B53309)
- IOTest3固定液(贝克曼库尔特产品编号:A07800
- 适配(常规12x75 mm)样品管的离心机
- 处理血样和抗体的装备(移液器、吸头、手套等)
染色方案和实验工作流
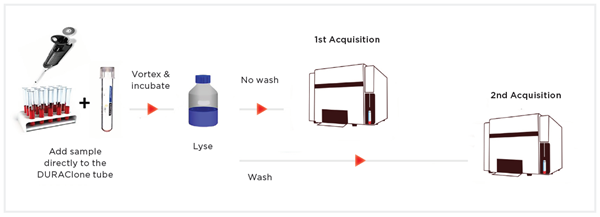
每个实验室按如下步骤分别制备5份样品:
- 将100μL ClearLLab Control Cells Normal制剂添加至IM Basic reagent DURAClone管中。
- 高速涡旋混合15秒。
- 室温下避光培养15分钟。
- 添加2mL VersaLyse裂解液。
- 添加50μL IOTest3固定液。
- 高速涡旋混合5秒。
- 室温下避光培养20分钟。
每份样品分别采集3次
- 以200 x g相对离心力离心5分钟。
- 吸取或倒出上清液并废弃。
- 轻轻敲击细胞沉淀物。
- 在0.5mL PBS中重悬细胞沉淀物。
每份样品采集3次
图2. 实验工作流示意图。
仪器设置
(第5章 仪器质量控制与标准化,第6章 数据采集和样品分析,第7章 DxFLEX的补偿设置 说明书产品编号C44966.AA)
靶值标准化
为确保以相同条件处理所有样品,本次实验按照贝克曼技术说明 “CytoFLEX增益表征”(文件号:FLOW-656502.20)所述增益调整方案优化实验设置。
FlowSet Pro质控微球(贝克曼库尔特产品编号:A63492*)在优化实验设置下运行。将所得荧光强度中值添加至标准化工具和生成的.tgt文件中,并与多个研究中心的实验参与者共享。
生成标准化目标文件
- 进入“QC/标准化”菜单,打开“开始QC/标准化”。
- 进入“设置”菜单,打开“标准化靶值库”。
- 单击“添加”。
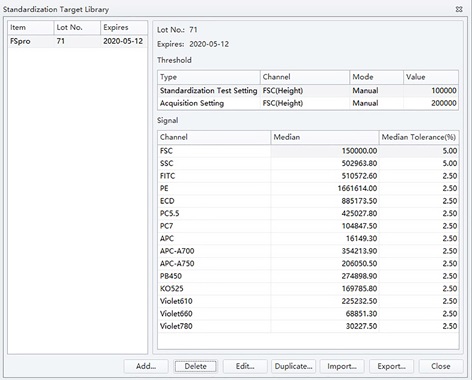
- 完成标准化靶值库。见图3
- 选择OK保存目标值。
- 填入所有值后点击“关闭”,自动生成“标准化目标文件”(文件名为FSpro-71.tgt)。导出该文件并与其他实验参与者共享,参与者将其导入各自标准化库中。
图3. 增益优化后使用第71批次Flow Set Pro 微球获得DXFLEX目标值。数据仅供参考。
运行标准化实验
- 导入.tgt文件后即可运行标准化实验。
- 点击打开软件的QC/标准化模块

- 选择标准化。.
- 检查系统配置是否为默认配置。
- 检查载板设置,将试管固定在转盘相应位置。
- 选择Flow-Set Pro微球批次号(本例为71)。
- 将15~20滴(约0.5 mL)Flow Set Pro微球滴入试管,运行标准化工具。
- 所获增益标记为“标准设置”。自动在库中保存为“S”设置。
- 每次运行标准化方案时这些设置将自动更新。
生成补偿矩阵
使用DxFlex自动补偿应用程序生成补偿矩阵(请参阅DxFLEX 使用说明书)。
ClearLLab质控细胞经IM Basic补偿试剂染色后,使用“标准设置”采集。
所获“IM Basic补偿”保存至DxFLEX补偿库。
Panel实验创建和设置
- 选择“File(文件)→New Panel Experiment(新建Panel实验)”。
- 选择新建位置和名称,例如“IM Basic标准化实验”。
- 添加New Empty(新的空白)样品,右键单击生成的样品1,选择“new tube(新管)”。
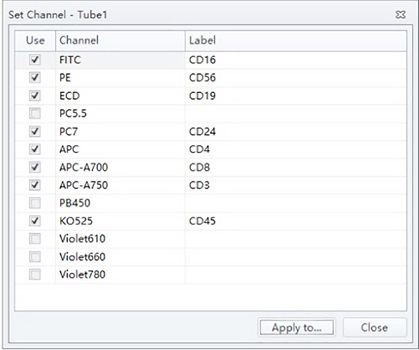
- 选择“设置 → 通道设置”:选择相应通道,输入标签说明。点击“关闭”。
图5. 设置标签窗口。
- 右键单击“Tube 1(管1)” 和“Link to Settings from Catalog(从目录链接到设置)”。链接到标准化“Standard settings(标准设置)”。
- 选择
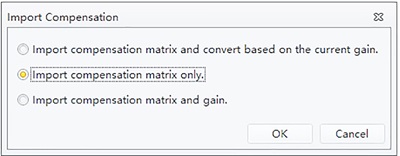
 “Compensation Matrix(补偿矩阵):从库中导入”图标,导入补偿矩阵。
“Compensation Matrix(补偿矩阵):从库中导入”图标,导入补偿矩阵。 - 选择“IM Basic compensation (IM Basic补偿)”补偿矩阵,并选择仅导入补偿矩阵。
图6. 导入补偿窗口。
- 生成采样工作表
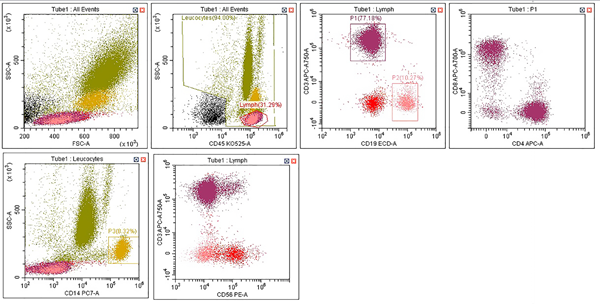
图7. Cytexpert for DxFLEX软件分析示例。点图仅供参考。
- 将“Tube 1”重命名为“1 run”并点击两次“Duplicate without data(无数据重复)”,以生成一式三份运行样品。
- 右键单击Sample 1,并点击五次“Duplicate without data”,创建完整的采集工作表。注:该工作表将在不同的样品程序(洗涤前和1个洗涤周期后)下运行两次。
样品采集
每份样品分别在裂解后,洗涤前/后采集3次并使用之前生成的补偿和设置进行快速采集,“Leucocytes(白细胞)”门的停止条件设为50,000。
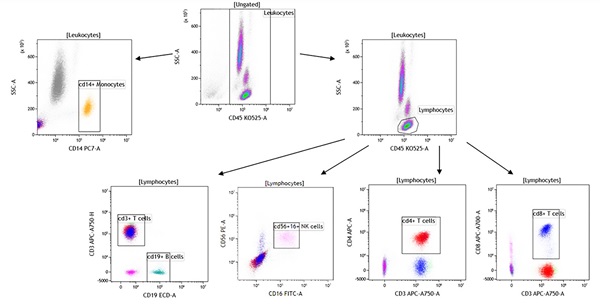
数据分析:设门策略和离线补偿
收集采用相同设门策略和补偿的3台评估仪的数据,并使用Kaluza C软件进行分析。
导出分析后的数据,在Excel中进行统计分析。
图9. Kaluza C软件设门策略示例。
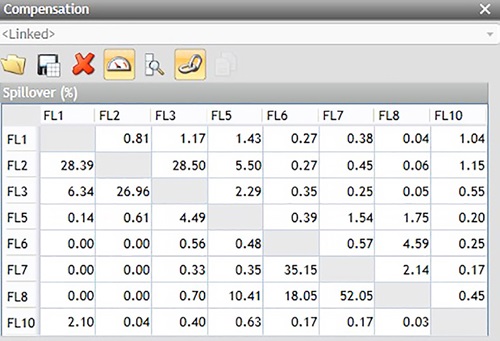
图10. 分析用补偿矩阵。数据仅供参考。
结果与讨论
样品程序对结果的影响
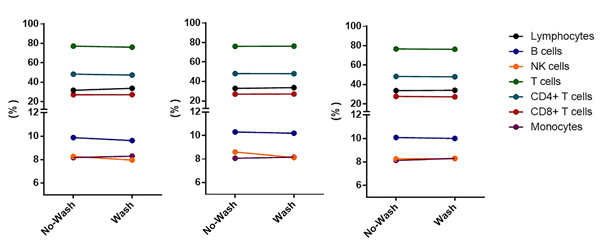
如图11,配对t检验结果的数据显示,洗涤和未洗涤程序之间未出现显著差异。
图11. 配对t检验结果,每个点表示5份样品的中值。计算得出淋巴细胞和单核细胞占白细胞总数的百分比,以及所有其他细胞群占淋巴细胞总数的百分比。
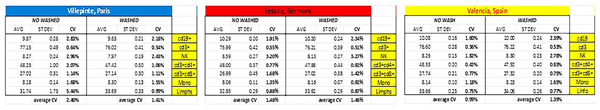
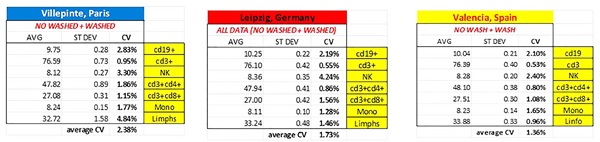
如表1所示,其他统计评估显示,洗涤和未洗涤程序的平均值相似。此外,我们还计算了标准偏差和变异系数,不同研究中心的所有平均CV均低于2.5%。
表1. 洗涤和未洗涤程序所得平均值、标准偏差和变异系数。
洗涤和未洗涤程序共用一套标准化设置,可最大限度降低仪器校准设置的复杂性,而且多个应用程序使用相同的唯一标准化设置,使工作流得以简化,从而节省实验室成本和时间。
实验室内结果:同一台仪器的准确度
如图12,ANOVA(方差)分析结果显示,两套程序处理下每个细胞群的不同样品之间无统计差异。
图12. 重复测量单因素ANOVA分析结果,每个点表示3次重复的中值。计算得出淋巴细胞和单核细胞占白细胞总数的百分比,以及所有其他细胞群占淋巴细胞总数的百分比。
由于我们已证明不同样品程序之间的结果无显著差异,所以将所有数据汇总并进行集中分析。如表2所示,CV结果表明同一实验室内存在差异,不同研究中心的所有平均CV均低于2.5%。
表2. 洗涤和未洗涤程序数据合并分析所得平均值、标准偏差和变异系数。
低重复样品变异系数是证明实验有效开展和所得数据精准的关键证据。所有研究中心不同采集样品中每个被检测细胞群的数据高度一致,经洗涤和未经洗涤处理结果均如此。实验结果表明,采用该方法,各实验室内数据可靠且准确。
不同实验室间结果:多研究中心间的结果准确度
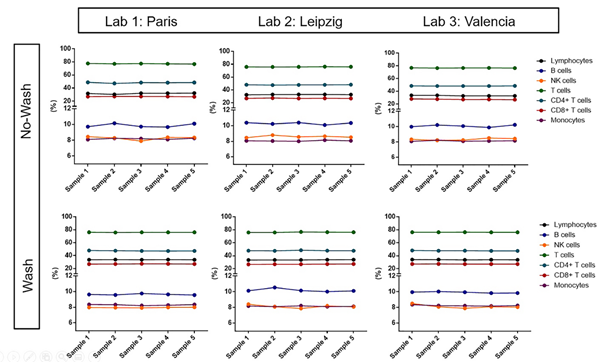
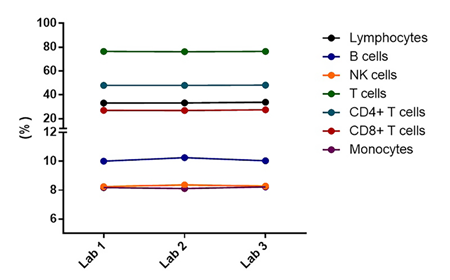
对不同研究中心数据进行分析,以评估不同实验室间的结果差异性。如图13,ANOVA分析结果显示,每个细胞群的不同实验室间的结果无统计差异。
图13. 实验室1:巴黎,实验室2:莱比锡,实验室3:巴伦西亚。重复测量单因素ANOVA分析结果,每个点表示5份样品分别在两种程序运行条件下的中值。计算得出淋巴细胞和单核细胞占白细胞总数的百分比,以及所有其他细胞群占淋巴细胞总数的百分比。
重复测量单因素ANOVA分析数据图中,每个点表示5份样品分别在两种程序运行条件下的中值。计算得出淋巴细胞和单核细胞占白细胞总数的百分比,以及所有其他细胞群占淋巴细胞总数的百分比。
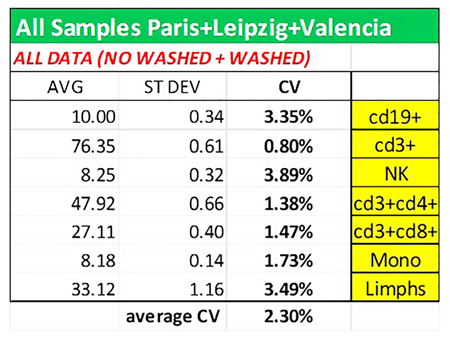
如表3所示,所有数据汇总分析,平均CV小于2.5%。
表3:不同实验室的全部数据(洗涤和未洗涤程序)汇总分析所得平均值、标准偏差和变异系数
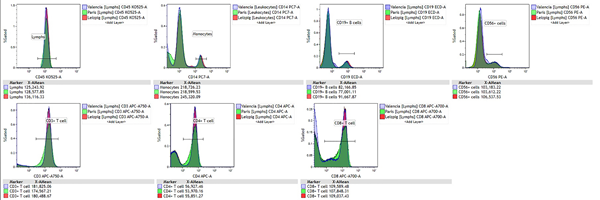
此外,本研究还对生成的分析图像进行了评估,特别对直方图进行叠加,以分析不同研究中心之间阳性群MFI(平均荧光强度)的差异。
图14. 不同研究中心被检测细胞群直方图叠加。显示用于统计分析的MFI。
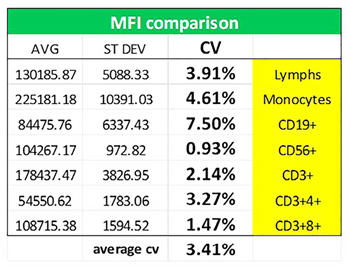
如表4所示,对MFI进行分析,平均CV小于3.5%。
表4. 不同研究中心直方图MFI平均值、标准偏差和变异系数。
分析显示,不同研究中心的百分比和MFI数据无统计差异。实验室间的一致性表明结果具有可靠性及可重现性。
结论
有效简化一台或多台DxFLEX平台的标准化设置工作流。
经简化的应用程序标准化设置工作流将提高临床研究效率。DxFLEX平台支持CytExpert for DxFLEX软件内置标准化功能,可在用户定义的目标值范围内每日自动校准增益设置,并在不同DxFLEX平台的相同应用中执行同一目标值。
为了减少不同实验室研究结果的差异,提高各临床研究中心的一致性,我们在本白皮书中证明,贝克曼库尔特DxFLEX系统支持简化、可靠的标准化工作流,可在跨仪器间获得一致的细胞样品检测结果。
参考文献
- Lacombe, F. et al. Harmonemia: a universal strategy for flow cytometry immunophenotyping-A European LeukemiaNet WP10 study. Leukemia 30, 1769–1772 (2016).
- Kalina, T. et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols . Leukemia 26, 1986–2010 (2012).
- Schwartz, A., Marti, G. E., Poon, R., Gratama, J. W. & Fernández-Repollet, E. Standardizing flow cytometry: A classification system of fluorescence standards used for flow cytometry. Cytometry (1998). doi:10.1002/(SICI)1097-0320(19981001)33:2<106::AID-CYTO4>3.0.CO;2-H
- Maecker, H. T., McCoy, J. P. & Nussenblatt, R. Standardizing immunophenotyping for the Human Immunology Project. Nat. Rev. 12, 191–200 (2012).
- Perfetto, S. P., Ambrozak, D., Nguyen, R., Chattopadhyay, P. & Roederer, M. Quality assurance for polychromatic flow cytometry . Nat. Protoc. 1, 1522–1530 (2006).
DxFLEX作为一款体外诊断医疗器械,仅限于经所在国当地监管部门批准后使用。购买前请咨询当地销售代表。
* DURAClone IM Phenotyping Basic Tube仅用于研究,不用于诊断。
FlowSet Pro微球:仅用于研究,不用于诊断。
FlowSet Pro微球作为DxFLEX CE系统的一部分尚未经验证,因此仅用于一般标准化过程演示。DxFLEX Daily QC Fluorospheres荧光微球或任何其他与您的应用相关的参比物质均可用作标准化样品。